Kiểm soát chất lượng trong IVF
Kiểm soát chất lượng trong IVF không chỉ yêu cầu cho kiểm định chất lượng phòng labo IVF, mà còn tạo dựng nền móng cho sự thành công của chương trình hỗ trợ sinh sản. Hiện nay một số thử nghiệm đã được sử dụng để sàng lọc môi trường và vật tư sử dụng trong trung tâm IVF. Tuy nhiên, ý nghĩa của nhiều thử nghiệm trong số này vẫn bị nghi ngờ. Ví dụ như thử nghiệm phôi chuột – MEA là phương pháp được cho là tin cậy nhất để kiểm tra sản phẩm IVF. Thử nghiệm này chủ yếu được đánh giá bằng tỷ lệ phôi nang sau 96 giờ nuôi cấy. Tỷ lệ 80% phôi nang được coi là ngưỡng chấp nhận được và sản phẩm kiểm tra được coi là an toàn cho phôi. Chỉ tiêu đánh giá này không tính đến chất lượng phôi nang (số lượng tế bào), hay sự phát triển phôi tại các thời điểm khác. Do đó khó có thể xác định sự không tối ưu của hệ thống nuôi cấy.
Kiểm soát chất lượng trong IVF là nhiệm vụ rất quan trọng để đảm sự vận hành tối ưu của tâm IVF lâm sàng. Chương trình này có thể giúp các chuyên viên phôi học theo dõi kết quả của phòng labo nuôi phôi, đảm bảo tính đồng nhất trong phòng thí nghiệm. Ngoài ra chương trình kiểm soát chất lượng xác định quy trình đã được thực hiện thỏa đáng. Tuy nhiên nhiều nhà chuyên môn nghi ngờ ý nghĩa thực tế của một số thử nghiệm QC đang được thực hiện như các thử nghiệm về vật chất và môi trường. Do đó trong bài viết này tập trung thảo luận vai trò và ý nghĩa của một số test và thử nghiệm liên quan với môi trường nuôi cấy phôi như sau:
- Kiểm tra áp suất thẩm thấu
- Đo pH
- Thử nghiệm nội độc tố
- Thử nghiệm tế bào sinh dưỡng
- Sống sót tinh trùng
- Thử nghiệm phôi chuột
- Sự phát triển phôi nhận được từ trứng hiến
Quy tình kiểm soát chất lượng trong IVF
Kiểm tra áp suất thẩm thấu
Nên thực hiện đo áp suất thẩm thấu nhiều lần với một mẫu để thu được giá trị tin cậy. Giá trị đo được phải nằm trong khoảng chấp nhận được. Việc đo áp suất thẩm thấu sẽ giúp xác định việc chuẩn bị môi trường được thực hiện chính xác. Vì vậy nên thực hiện đo áp suất thẩm thấu sau mỗi lần chuẩn bị môi trường. Nếu áp suất thẩm thấu của mẻ môi trường quá cao, cũng không thể sử dụng nước để làm giảm áp suất thẩm thấu xuống. Môi trường này nên được loại bỏ và chuẩn bị lại.
Đo pH
Khi tiến hành đo pH cần sử dụng môi trường đã được ủ qua đêm trong tủ ấm CO2 với nồng độ CO2 sử dụng trong nuôi cấy. Mẫu nên được đặt ở 37oC hoặc được đo với máy đo pH với chỉnh nhiệt độ thích hợp. Giá trị pH cũng nên nằm trong khoảng chấp nhận, nếu không môi trường phải được loại bỏ. Tuy nhiên, nên sử dụng nhiều mẫu cho mỗi lần phân tích pH để có được kết quả chính xác nhất. Cần đo pH ngay khi môi trường được mang ra khỏi tủ ấm nuôi cấy.
Thử nghiệm nội độc tố
Thử nghiệm phổ biến nhất cho nội độc tố là test limulus amebocyte lysate. Thử nghiệm này dựa vào một phản ứng enzyme sinh học. Một thử nghiệm như vậy vượt quá mục tiêu của phòng thí nghiệm thông thường. Bởi vậy, kiểm nghiệm này nên được thực hiện bởi một cơ sở có chứng chỉ. Ý nghĩa của mức nội độc tố được minh họa bởi Nagata và Shirakawa. Một nguồn phổ biến của nội độc tố có thể từ hệ thống nước tinh sạch. Bởi vậy nếu môi trường được tự pha chế trong phòng thí nghiệm, nó cần được kiểm tra thường xuyên với thử nghiệm nội độc tố.
Sử dụng dòng tế bào không phải phôi
Đây là phương pháp thử nghiệm thay thế (thường là dòng tế bào lai hybridoma), mặc dù những tế bào này khi nuôi cấy có thể đặc biệt nhạy với độc tố trong môi trường, chúng không phải tế bào phôi và bởi vậy có thể không xác định được tiềm năng độc tính với phôi. Bởi vậy hiệu lực của chúng trong trung tâm IVF lâm sàng bị nghi ngờ, đặc biệt các dòng tế bào sẽ phát triển trong một môi trường thiếu các thành phần cho phân cắt phôi, như pyruvate và lactate.
Test tinh trùng
Một thử nghiệm sinh học thay thế khác là sử dụng sự di động tinh trùng để xác định độc tính tiềm năng với phôi. Tinh trùng chuột hasmter đã được sử dụng để kiểm tra độc tính của môi trường và các thành phần môi trường. Thử nghiệm này sử dụng cả số lượng tinh trùng di động và mức độ di động để xác định sự thích hợp của môi trường cho sự phát triển phôi. Một ưu điểm của thử nghiệm này có thể được thực hiện trong 4-6 giờ ngược lại với thời gian vài ngày khi sử dụng thử nghiệm phôi. Tuy nhiên, dữ liệu lâm sàng vẫn hạn chế về khả năng áp dụng của những thử nghiệm này.
Thử nghiệm tinh trùng người cũng được sử dụng cho xác định độc tính tiềm tàng. Tuy nhiên, thử nghiệm này cũng không xác định độc tố với phôi, và bởi vậy độ nhạy của thử nghiệm này và sự liên quan của nó với phôi vẫn bị nghi ngờ.
Thử nghiệm phôi chuột
Một trong những thử nghiệm sinh học được sử dụng rộng rãi nhất cho sàng lọc môi trường, các thành phần môi trường nuôi cấy, và thiết bị được sử dụng trong IVF lâm sàng là thử nghiệm phôi chuột tiền làm tổ (MEA). Sử dụng phôi chuột để thử nghiệm môi trường dành cho nuôi phôi người đã được thảo luận rất nhiều và cũng có nhiều báo cáo phản đối trong y văn về sự phù hợp của thử nghiệm này. Fukuda vào cộng sự báo cáo rằng đối với chuột, thụ tinh in vitro và sự phát triển của hợp tử, phôi hai tế bào khi nuôi cấy tương quan với sự tinh sạch của nguồn nước được sử dụng cho chuẩn bị môi trường. Ngược lại, George cùng cộng sự và Silverman cùng cộng sự nhận thấy môi trường được chuẩn bị với nước máy có thể hỗ trợ sự phát triển đầy đủ phôi một tế bào và hai tế bào tới giai đoạn túi phôi, khi so sánh với môi trường được chuẩn bị với nước siêu sạch. Mâu thuẫn rõ ràng của những nghiên cứu này có thể được giải quyết bởi tính đến các giai đoạn khác nhau của sự phát triển được sử dụng ở thời điểm bắt đầu nuôi cấy, kiểu môi trường được sử dụng, và sự bổ sung môi trường với protein. Fukuda và cộng sự sử dụng môi trường Bigger, Whitten, và Whittlingham (BWW), một môi trường kiểu đơn thiếu amino acid, trong khi Silverman và cộng sự sử dụng Ham’s F10. Môi trường sau chứa amino acid, các chất này có thể bắt bất cứ độc tố nào có mặt trong nước máy (ví dụ kim loại nặng). George và cộng sự sử dụng mức cao của albumin huyết thanh trong nuôi cấy hợp tử tới túi phôi. Albumin có thể bắt các chất độc với phôi và bởi vậy loại bỏ ảnh hưởng của bất cứ thứ gì có trong môi trường nuôi cấy. Hơn nữa, tất cả các nghiên cứu sử dụng sự phát triển túi phôi như tiêu chuẩn duy nhất cho đánh giá sự phát triển phôi. Sự phát triển túi phôi là một chỉ thị kém của chất lượng phôi và không phản ánh tiềm năng phát triển. Một xem xét bổ sung là hầu hết các nghiên cứu sử dụng thử nghiệm phôi chuột cho xác định độc tố với phôi thường nuôi phôi trong 24 đến 48 giờ dài hơn sự phát triển túi phôi xuất hiện in vivo, ví dụ sự phát triển phôi vào ngày 4. Hơn nữa, các thông số nhạy và định tính hơn là số lượng tế bào của túi phôi.
Phát triển nhiều quy trình xác định hơn đối với thử nghiệm các vật liệu thô và sản phẩm cuối cùng là một sự ưu tiên để cải thiện sự hữu ích của thử nghiệm MEA. Môi trường đơn giản dựa trên G1 đã được tạo với một MEA nhạy hơn. Những môi trường này (không có amino acid, ethylenediaminetetraacetic acid, và vitamin giúp tăng khả năng phát triển phôi) được sử dụng để cho phôi tiếp xúc với vật liệu thô (bao gồm hóa chất và dầu) trong một khoảng thời gian 96 giờ. Phụ thuộc vào hóa chất, tới ba thử nghiệm riêng biệt được thực hiện trên mỗi thành phần môi trường và dầu. Những thứ này bao gồm nuôi cấy phôi với và không có protein và sử dụng chuột CF1 để tạo một phương pháp test phôi chuột toàn diện hơn.
Kiểu thử nghiệm được thực hiện phụ thuộc vào tuổi phôi khi nhận và dòng chuột được sử dụng. Ảnh hường của điều kiện nuôi cấy lên phôi chuột là tỷ lệ nghịch với tuổi phôi khi thu (ví dụ phôi một tế bào là dễ bị tổn thương với độc tính hơn phôi được thu ở giai đoạn hai tế bào. Hơn nữa, kiểu thử nghiệm phôi chuột phụ thuộc vào dòng chuột. Dòng Inbred và dòng lai F1 của chúng là ít nhạy hơn với môi trường của chúng và bởi vậy phôi được thu ở giai đoạn hợp tử. Phôi từ dòng outbred nhạy hơn với các nhân tố môi trường. Hạn chế của việc sử dụng những dòng outbred cho thử nghiệm ở chuột là do chúng biểu hiện sự dừng ở giai đoạn hai tế bào trong môi trường nuôi cấy. Tuy nhiên, với sự phát triển gần đây của điều kiện nuôi cấy tối ưu, hiện nay có thể nuôi cấy những phôi này thường quy từ giai đoạn hợp tử. Loại bỏ màng sáng khỏi hợp tử tăng độ nhạy của phôi với điều kiện nuôi cấy và nội độc tố.
Thử nghiệm phôi chuột đã chứng minh hữu ích trong việc sàng lọc các độc tố tiềm tàng với phôi có mặt trong dụng cụ được sử dụng trong công việc lâm sàng. Việc sử dụng hiện nay của các thử nghiệm ổn định, được yêu cầu cho các sản phẩm được chấp thuận bởi FDA, đã cho phép kiển tra vật liệu sản xuất, môi trường nuôi cấy, và các mẻ dầu. Do đó, MEA được sửu dụng trong phòng thí nghiệm có thể xác định một vấn đề xuất hiện từ nguồn dầu paraffin thô trong các thùng dầu. Trong khoảng thời gian vài tháng, dầu mà đã được kiểm tra nguồn gốc và được thất an toàn ổn định trở nên độc bởi vì bình chứa trong đó nó được lưu trữ. Vấn đề được xác định trước khi bất cứ sản phẩm cuối nào được sản xuất vấn đề được giải quyết với nhà cung cấp.
Một thử nghiệm phôi chuột thực tế là nuôi cấy hợp tử trong 24 giờ trong sự có mặt của albumin và sau thêm 72 giờ trong điều kiện hoàn toàn thiếu protein và trong một môi trường thiếu amino acid. Lý do cho việc sử dụng môi trường không chứa protein là do huyết thanh hoặc albumin có thể bắt độc tố, như ion kim loại nặng, có mặt trong môi trường. Sự có mặt của protein bởi vậy sẽ làm ẩn đi các ảnh hưởng độc tính tiềm tàng của môi trường. Kích rụng trứng nhiều được kích ứng bởi tiêm từ cái 4-6 tuần tuổi với 5IU huyết thanh PMSG (huyết thanh ngựa chửa), sau đó 48 tiếng với 5 IU hCG. Con cái được ghép đôi cùng con đực ngay sau mũi tiêm thứ hai và được kiểm tra sự có mặt của plug âm đạo vào sáng hôm sau. Đĩa nuôi cấy nên được chuẩn bị và cho phép được làm cân bằng qua đếm trong 6% CO2 trong không khí. Một môi trường gần 20% O2 được sử dụng để gây stress thêm với phôi trong nuôi cấy, cho rằng phôi chuột phát triển tốt hơn với nồng độ O2 5% so với nuôi trong 20%. Phôi được nuôi cấy theo nhóm trong 10 đến 20 microliter giọt môi trường dưới dầu ở 37 độ C. Để khắc phục bất cứ sự khác nhau về mẫu hiến nào, phôi từ mỗi con cái nên được phân chia đều tới mỗi nhóm. Quy trình được sử dụng để thực hiện nuôi cấy đã được báo cáo đầu đủ.
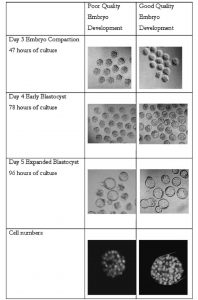
Đánh giá sự phát triển phôi
Hình thái phôi được đánh giá và sự hình thành túi phôi được xác định sau 96 giờ nuôi cấy. nếu nhiều hơn 80% hợp tử đạt đến giai đoạn túi phôi, môi trường hoặc dụng cụ được kiểm tra đó được xem là an toàn sử dụng an toàn cho lâm sàng. Tuy nhiên, nếu chỉ dựa vào số lượng túi phôi sau 96 giờ thì thông tin về môi trường nhận được rất hạn chế.
Một cách tiếp cận thích hợp hơn là sử dụng phân tích trình tự phát triển phôi, gần giống với những gì được sử dụng cho phôi người IVF. Sử dụng phương pháp này, các điểm kiểm tra rời rạc được chọn và phôi được đánh giá. Hơn nữa chất lượng của phôi nang như số lượng tế bào cũng cần được đánh giá. Hơn thế nữa, thực hiện chuyển phôi là phương pháp cuối cùng của thử nghiệm khả năng của một môi trường, hoặc một vật tư tiếp xúc, để hỗ trợ sự phát triển phôi bởi vì ảnh hưởng mãn tính của nội độc tố là biểu hiện chung sau chuyển.
Không may thay, một cách tiếp cận chi tiết với QC là tốn thời gian và có lẽ vượt quá khả năng của hầu hết các trung tâm IVF. Hơn nữa, việc sàng lọc hàng tuần của môi trường bởi thử nghiệm phôi chuột rất tốn kém, cả về mặt thời gian đối với phòng thí nghiệm và động vật.
Mặc dù MEA có một vai trò trong IVF lâm sàng, nhưng tốt nhất nó chỉ là test khả năng của phôi chuột phát triển. Không có sự đảm bảo rằng các nhân tố mà không ảnh hưởng phôi chuột sẽ không độc với phôi người. Kiểm soát chất lượng cuối cùng trên tất cả môi trường cho IVF là có thể hỗ trợ sự phát triển phôi người. Tuy nhiên, rõ ràng là phi đạo đức nếu sử dụng phôi người cho mục đích này. Theo dõi cẩn thận sự phát triển phôi trong phòng IVF không chỉ cần thiết, mà còn nên được xem xét như một phần của hệ thống QC chung của phòng thí nghiệm. Bởi vậy việc này tăng lên của việc bao gồm chương trình hiến trứng, hoặc bệnh nhân trẻ tuổi (trẻ hơn 35) như một phần chương trình quản lý chất lượng tổng thể phòng thí nghiệm.
Hiến trứng và QC
Một giải pháp có thể với vấn đề đạo đức trong việc sử dụng phôi người cho QC là sử dụng phôi tam bội như một thử nghiệm chất lượng môi trường, mặc định những thứ này không thể được chuyển vào người mẹ. Khi sử dụng sự phát triển phôi tam bội để theo dõi điều kiện nuôi cấy, phải nhớ rằng phôi thường được nhận từ bệnh nhân hiếm muộn. Điều này ngược lại với phôi nhận được tử động vật có vú-là chúng là những loài trong phòng thí nghiệm hoặc vật nuôi. Tuy nhiên, ưu điểm của chương trình hiến trứng, chúng ta hiện nay đánh giá giao từ từ phụ nữ trẻ tuổi. Phôi nhận được từ những trứng này có lẽ phát triển tỷ lệ thích hợp hơn, và bởi vậy, nó hữu ích để xác định liệu phòng thí nghiệm có chức năng tối ưu hóa ở mức tối thiểu của nó. Ngược lại, khi phôi của bệnh nhân được theo dõi, một lỗi phát triển có thể được cho là bệnh nhân hơn là vấn đề bản chất môi trường nuôi cấy.
Kết luận
Một thử nghiệm đơn là không đủ đối với QC tổng thể phòng thí nghiệm. Bởi vì sản xuất môi trường nuôi cấy phôi đã được chuyển sang lĩnh vực thương mại, mỗi công ty nên cung cấp các giấy tờ thích hợp của thử nghiệm được sử dụng trong việc sản xuất môi trường. Bất cứ thiết bị y tế nào mà tiếp xúc trực tiếp với giao tử và phôi, như đĩa, hay ống nên được kiểm tra cho vô trùng, nội độc tố và MEA, ở mức tối thiểu. Bởi vậy, đảm bảo rằng một số thử nghiệm QC được đặt đúng vị trí sẽ giảm sự khác biệt trong phát triển phôi và nên ngăn chặn hiệu một tổng phân trong hệ nuôi cấy. QC và MEA là quan trọng cho hệ thống quản lý chất lượng trong phòng IVF vì chúng đại diện các thành phần chủ chốt trong kiểm soát phòng ngừa. Theo dõi các thông số chủ chốt trong phòng thí nghiệm, như chất lượng phôi, sau sử dụng tất cả các thành phần mới là cần thiết để đảm bảo rằng sự toàn vẹn của tất cả các hệ thống được duy trì.





