Ứng dụng của hệ điện di thẳng đứng
Sử dụng hệ điện di thẳng đứng để xác định trọng lượng phân tử
Trọng lượng phân tử của một protein có thể được xác định bởi sự di chuyển tương đối Rf với log của trọng lượng phân tử protein chuẩn qua hệ điện di thẳng đứng.
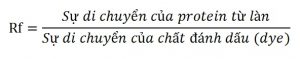
Giá trị của di chuyển tương đối (Rf) được tính từ SDS-PAGE. Đối với mỗi băng protein, một dòng kẻ được vẽ ở giữa băng và sau đó khoảng cách từ đó tới làn chạy được đo. Khoảng cách đối với chất đánh dấu điện di (dye) ở phía trước cũng được đo. Giá trị của di chuyển tương đối (Rf) và log của trọng lượng phân tử protein chuẩn được sử dụng để vẽ ra đường cong chuẩn hóa để tính ra trọng lượng phân tử của mẫu chưa biết.

Sử dụng hệ điện di thẳng đứng để xác định trạng thái oligo của protein
Điện di gel polyacrylamide có thể được sử dụng để xác định trạng thái oligo của protein. Một mẫu protein có thể được chạy dưới điều kiện biến tính cũng như tự nhiên trong hai bản gel tách biệt. Protein có trọng lượng phân tử đã biết chạy ở cả hai bản gel và giá trị Rf được tính cho protein chuẩn như đã được mô tả. Một đường cong chuẩn hóa từ gel tự nhiên và biến tính được sử dụng để xác định trọng lượng phân tử protein trong hai trạng thái (tự nhiên và biến tính). Trạng thai oligo của protein được tính từ công thứ được đưa ra dưới đây:
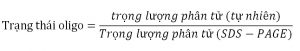
Hệ điện di thẳng đứng dùng để nghiên cứu protein gấp cuộn và không gấp cuộn
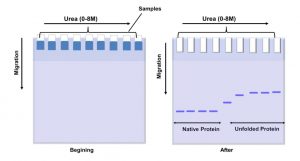
Urea phá hỏng liên kết tĩnh điện và kỵ nước giữa amino acid của protein để do đó phá vỡ cấu trúc 3D của phân tử protein. Nó được sử dụng rộng rãi để nghiên cứu phá bỏ sự gấp cuộn của protein và xác định cấu trúc trung gian khác nhau trong quá trình gấp cuộn. Trong một thí nghiệm loại bỏ gấp cuộn điển hình, protein được tiếp xúc với nồng độ khác nhau của urea và sau đó những biến đổi cấu trúc của protein có thể được theo dõi bởi kỹ thuật quang phổ hoặc lọc gel. Tháo cuộn gập protein gây ra tăng về thể tích thủy động lực học và nó dẫn đến sự di chuyển chậm trong gel polyacrylamide. Trong Urea PAGE, gel polyacrylamide được chuẩn bị với một gradient urea nằm ngang (0-8M). Cùng mẫu protein được tra lên các làn chạy khác nhau cho phép chạy theo chiều thẳng đứng, vuông góc với gradient urea. Vì mẫu chạy ở các làn khác nhau, nó tiếp xúc với nồng độ urea khác nhau và dẫn đến ở một nồng độ urea đặc biệt protein được gỡ cuộn gập với mức độ tăng về thể tích thủy động học. Mẫu protein đã gỡ cuộn gập sẽ di chuyển chậm hơn do đó tăng lực ma sát và nó tạo ra một kiểu băng protein duy nhất để cung cấp cho định lượng hoặc bán định lượng về loại protein trung gian trong quá trình cuộn gập. Thông tin từ điện di gradient urea PAGE cần được xác nhận thêm từ các kỹ thuật phân tích khác. Hơn nữa với cuộn gập protein, urea PAGE cũng có thể được sử dụng trong phân tích phức hợp protein cũng như các liên kết không cộng hóa trị của protein.
Sử dụng hệ điện di thẳng đứng trong tinh sạch kháng nguyên-SDS-PAGE
SDS-PAGE đã được sử dụng thường quy trong quy trình tinh sạch protein (kháng nguyên) để tạo kháng thể. Protein quan tâm được tạo ra với số lượng lớn ở vi khuẩn hoặc các hệ thống biểu hiện thích hợp khác. Sau đó, mẫu nghiền vi khuẩn thô được phân tách trên gel midi hoặc maxi chứa một làn hợp nhất để tra một lượng mẫu nghiền vì khuẩn lớn (2-3 ml). Một làn gel duy nhất có thể được phân tích hoặc bởi nhuộm hoặc với lai western blotting để xác định vị trí của protein trên gel. Vị trí gel chứa protein mong muốn được cắt và protein được tách bằng điện khỏi gel. Protein được cô lạnh và sử dụng cho tiêm chủng ở động vật như chuột hoặc thỏ.
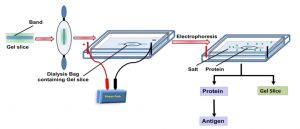
Sử dụng hệ điện di thẳng đứng đê nghiên cứu tương tác protein-protein
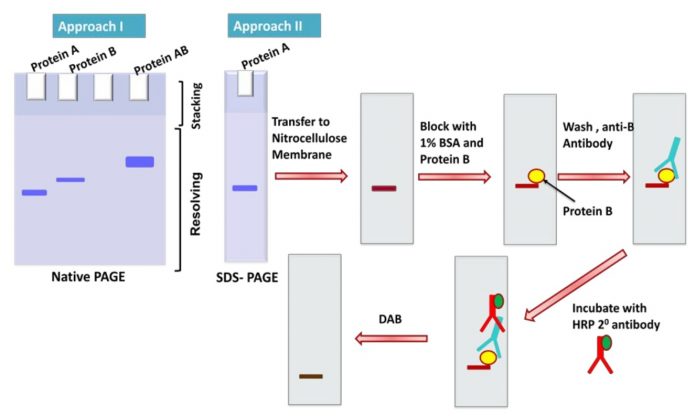
Có hai phương pháp trong đó điện di gel đứng có thể được sử dụng để nghiên cứu tương tác protein. Trong phương pháp thứ nhất, protein A và B được ủ trong một phản ứng invitro để tạo phức hợp AB. Sự hình thành phức hợp AB này có thể được phân tích trên một native PAGE. Như được chỉ ra ở hình bên dưới, khi phức hợp được hình thành, sẽ có một sự chuyển đổi vị trí của băng khi so sánh với băng của từng protein. Trong phương pháp thứ 2, protein A được phân tách trên gel SDS-PAGE và được chuyển lên màng nitrocellulose. Màng được khóa (block) với 1% BSA qua đêm ở 4oC. Màng nitrocellulose được ủ với protein B qua đêm ở 4oC. Màng được rửa với đệm và được thăm dò với kháng thể anti-B sau đó bởi kháng thể thứ hai ghép với HRP (antiIgG-HRP). Vết (Blot) được phát hiện bởi di-amino benzidine (DAB).

Xác định glycoprotein và phosphoprotein
Mẫu protein phân tách trên SDS-PAGE được nhuộm với các tác nhân khác nhau để xác định đặc hiệu glycoprotein và phosphoprotein. Tác nhân periodic acid Schiff đặc biệt nhuộm glycoprotein. Trong khi protein phosphoryl hóa có thể được xác định bởi gắn đánh dấu với 32P sau đó bởi chụp x-ray.
Trên đây là bài viết về ứng dụng của hệ điện di gel thẳng đứng. Chúng tôi hy vọng bài viết sẽ hữu ích cho quý khách. Ngoài ra chúng tôi cung cấp nhiều sản phẩm hóa chất và thiết bị y sinh như: EtBr, máy chụp ảnh gel, kính hiển vi quang học, máy ly tâm, kit tách ADN…