Điện di thẳng đứng
Điện di thẳng đứng được thực hiện theo cách không liên tục với đệm trong bể có phần trên và phần dưới kết nối với bằng một tấm gel (polyacrylamide). Hiện có rất nhiều cải tiến khác nhau với hệ thống điện di thẳng đứng để nhằm nghiên cứu và phân tích mẫu cho nhiều mục đích
Điện di thẳng đứng với gel polyacrylamide-SDS (SDS-PAGE)
Sơ đồ thiết bị của một hệ thống điện di gel thẳng đứng được thể hiện ở hình dưới đây. Nó có hai buồng đệm, buồng dưới và buồng trên. Cả hai buồng gắn với cực điện platin và được nối với nguồn bên ngoài từ một bộ nguồn cung cấp dòng trực tiếp hoặc điện áp DC. Phần dưới và phần trên của bể được làm đầy với đệm chạy mẫu, và được nối với nhau bằng gel điện di đúc giữa hai tấm kính (hình chữ nhật). Có các phụ kiện bổ sung được yêu cầu cho đúc gel polyacrylamide như lược (để chuẩn bị các giếng khác nhau), miếng đệm, khay đúc gel…

Đệm và hóa chất sử dụng đối với mục đích khác nhau của điện di gel thẳng đứng như sau:
- N, N, N’, N’-tetramethylethylenediamine (TEMED) – xúc tác polymer hóa acrylamide
- Ammonium persulfate (APS) – là một chất khởi đầu sự polymer hóa acrylamide
- Tris-HCL – là thành phần của đệm chạy và đệm đúc gel
- Glycine – là thành phần của đệm chạy
- Bromophenol blue là chất đánh dấu để theo dõi sự tiến triển của quá trình điện di gel
- Coomassie brilliant blue R250 – được sử dụng để nhuộm gel polyacrylamide
- Sodium dodecyl sulphate (SDS) – được sử dụng để biến tính và cung cấp điện tích âm cho protein
- Acrylamide – đơn phân được sử dụng để chuẩn bị gel
- Bis-acrylamide – chất liên kết chéo cho polymer hóa đơn phân acrylamide để hình thành gel
Đúc gel: Dung dịch acrylamide (một hỗn hợp của các đơn phân acrylamide và một chất bis-acrylamide nhưng không có chức năng) được trộn với TEMED và APS và được đổ vào giữa tấm thủy tinh trong khuôn đúc gel. Ammonium persulfate (APS) với sự có mặt của TEMED hình thành gốc ô xi hóa tự do và kích ứng sự polymer hóa của đơn phân acrylamide để hình thành một dạng polymer thẳng. Những sợi polymer thẳng này được liên kết với nhau bởi các đơn phân bis-acrylamide để hình thành một dạng lưới 3 D với các lỗ. Kích thước của lỗ được kiểm soát bởi nồng độ của acylamide và số lượng của bis-acrylamide trong gel. Trong một hệ điện di gel thẳng đứng, chúng ta có thể đúc hai kiểu gel, gel chồng (stacking gel) và gel phân giải (resolving gel). Dung dịch gel phân giải đầu tiên được chuẩn bị và được đổ vào băng gel cho polymer hóa. Một lớp mỏng của dung môi hữu cơ (như butanol hoặc isopropanol) được phủ lên để ngăn dự tiến vào của ô xi (ô xi trung hòa gốc tự do và làm chậm sự polymer hóa) và giúp tạo lớp trên mượt. Sau khi polymer hóa của gel phân giải (resolving gel), một gel chồng được đổ vào và lược được gắn khít trong gel tạo cấu trúc các làn khác nhau cho mẫu.

Chạy gel: mẫu được chuẩn bị trong chất đánh dấu màu điện di (loading dye) chứa SDS, β- mercaptoethanol trong glycerol để biến tính mẫu và sự có mặt của glycerol tạo điều kiện tra mẫu trong giếng. Vì mẫu được tra theo phương thẳng đứng có một sự khác biệt về khoảng cách giữa phân tử ở đầu làn so với phân tử ở đáy làn. Đây là vấn đề được để ý khi mẫu chạy thông qua Gel chồng (stacking gel). pH của gel chồng là 6.8 và ở pH này, Glycine di chuyển chậm về phía trước trong khi đó tris-HCL di chuyển nhanh. Do đó, mẫu có trạng thái bị kẹp (Sandwiched) giữa glycine và tris-HCL và được chồng thành dạng một băng mỏng. Khi mẫu tiến vào gel phân giải (resolving gel) với pH 8.8, glycine được tích điện, nó di chuyển nhanh và mẫu chạy theo trọng lượng phân tử của chúng (vì SDS tạo cho chúng cân bằng về điện tích âm). Sau khi theo dõi chất chỉ thị (dye) đạt tới đáy của gel điện di, gel được lấy ra khỏi tấm kính và được nhuộm với thuốc nhuộm coomassie brilliant blue R250. Thuốc này nhuộm protein có mặt trên gel. Một SDS-Page điển hình kết quả như hình dưới đây.
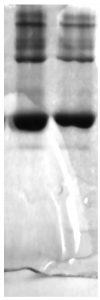
Trong SDS Page, sự di động tương đối và logarit trọng lượng phân tử như công thức bên dưới:
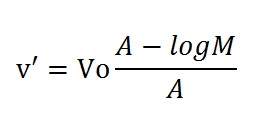
Trọng lượng phân tử của protein có thể được xác định bằng sự di động tương đối cá điểm Rf với log trọng lượng phân tử của protein chuẩn.
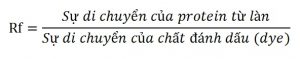
Native Page
SDS-Page được thảo luận bên trên sử dụng chất hoạt động bề mặt là sodium dodecyl sulfate và β-mercaptoethanol để tạo điện tích cân bằng với tất cả các protein và phá vỡ cầu disulphide. Do đó, cấu trúc 3D của protein bị phá hủy và nó di chuyển theo trọng lượng phân tử tiểu phần của chúng. Trong native page, mẫu được chuẩn bị trong chất đánh dấu màu điện di (loading dye) không chứa chất tẩy hoặc tác nhân biến tính và do đó mẫu chạy trên cơ sở điện tích/khối lượng. Trong native page, cấu tạo 3D cũng như hoạt tính của protein vẫn không bị ảnh hưởng.
Urea PAGE
Trong phương pháp này, protein không tan được hòa tan trong Urea và mẫu phân tách dựa trên điện tích/khối lượng tiểu phần. Một gradient ura PAGE được sử dụng để theo dõi trạng thái cuộn gập của phân tử protein.
Trên đây là bài viết về tổng quan hệ thống điện di đứng. Chúng tôi hy vọng bài viết này sẽ hữu ích cho quý khách. Ngoài ra chúng tôi còn cung cấp nhiều thiết bị sinh học phân tử như: máy pcr, kit tách ADN, kit tach ARN, heating block, vortex, tủ ấm, pipet điện tử, micropipet… Chúng tôi rất mong nhận được sự ủng hộ của quý khách.





